Introdução
Muito ouvimos falar das moléculas e o que elas compõem (H2O é a molécula que forma água, por exemplo), mas você já pensou em como ela é? Em como você poderia ilustra-la? O que é, afinal de contas, uma Geometria Molecular?
Primeiramente, vamos entender o que são as moléculas: elas são estruturas formadas por uma quantidade determinada de átomos quando estes compartilham elétrons e são ligados por ligações covalentes (ou ligações moleculares).
Quando se trata da molécula da água, ela é uma molécula simples e pode ser representada num único plano.
Há outras moléculas simples também, mas a maioria delas, que formam substâncias, são tridimensionais, o que significa que seus átomos se dispõem de diferentes formas no espaço.
Sendo assim, a geometria molecular trata da distribuição espacial dos átomos de uma molécula. É o desenho da figura geométrica dessa molécula quando unimos todos os núcleos dos átomos com linhas retas.
Dessa forma, seu tipo de classificação vai depender da quantidade de átomos e do elemento central formador da molécula – se o átomo central possui ou não par de elétrons livres.
Veja bem, todas as moléculas diatômicas, ou seja, aquelas que são formadas por 2 átomos apresentam uma única linha reta entre eles. Por isso, sua geometria é linear. No caso de moléculas triatômicas, a geometria pode ser linear ou angular.
Mas por que isso acontece na Geometria Molecular?
O que explica esse fenômeno é a Teoria da repulsão dos pares eletrônicos da camada de valência.
Ela se baseia na presença ou ausência de pares eletrônicos livres do átomo central, que se comportam como uma nuvem eletrônica.
Como eles se repelem entre si, a molécula tende a adquirir uma forma geométrica que consiga a maior distância angular possível.
Um grupo de elétrons pode ser:
- Uma ligação covalente simples;
- Uma ligação dupla;
- Uma ligação tripla;
- Um par de elétrons não ligantes.
Todos eles correspondem a uma nuvem eletrônica.
Desse modo, a geometria molecular é determinada pela posição dos núcleos dos átomos ligados ao átomo central, levando em consideração a interação entre as nuvens eletrônicas e suas repulsões.
Observe na imagem abaixo as diversas geometrias moleculares (de acordo com o número de átomos e de nuvens eletrônicas) e como fazer a classificação:
Vamos entender melhor?
Bem, se ainda restam dúvidas sobre quais são as geometrias moleculares, vamos deixar bem explicadinho pra você entender como classificar as moléculas:
#1 Linear
São moléculas com 2 ou 3 átomos;
- Quando a molécula tiver 2 átomos, não terá elemento central. Exemplo: H2
- Quando as moléculas tiverem 3 átomos no elemento central, não terá par de elétrons livres. Exemplo: CO2 (gás carbônico). Nele, C (carbono) é o elemento central e faz 4 ligações com os 2 O (oxigênio), e não possui mais nenhum par de elétrons livres.
#2 Angular
Aqui as moléculas tem 3 átomos e seu elemento central possui par de elétrons livres. Exemplo: H2O
Onde O é o elemento central e possui 2 pares de elétrons livres, o que caracteriza a geometria angular.
#3 Trigonal Planal
Possui 4 átomos onde não há pares de elétrons livres no elemento central. Exemplo: BF3
B (boro) é o elemento central e possui 3 ligações com o F (flúor), não sobrando elétrons livres. Obs: B é exceção da regra do octeto, pois tem 6 elétrons na sua última camada.
#4 Piramidal
Esta é formada por 4 átomos da molécula central.
Se o nitrogênio for o átomo central, há par de elétrons livres. Exemplo: NH3
#5 Tetraédrica
Esta é a mais fácil de identificar, pois é a única formada por 5 átomos. Seu elemento central não tem par de elétrons. Exemplo: CH4.
O carbono central tem 4 ligações com 4 hidrogênios.
Abaixo você pode conferir um resumo dessas formas geométricas: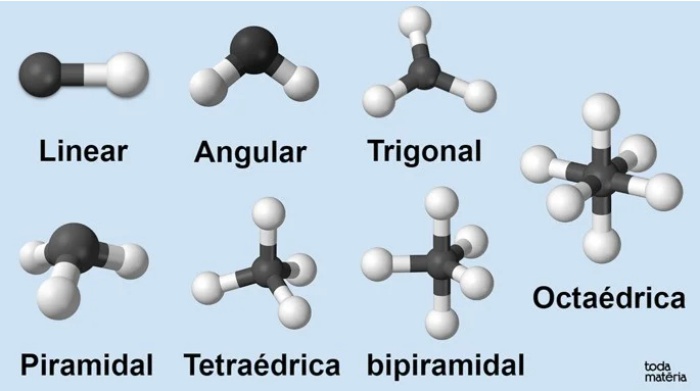
Geometria Molecular (fonte: https://www.todamateria.com.br/geometria-molecular/)
Conclusão
Bem, acho que já deu pra descomplicar um pouco essa matéria, né?!
Para complementar, você pode aplicar técnicas de estudo e de memorização, bem como utilizar um cronograma de estudos (faça o download aqui).
Assim, você garante um excelente resultado nas provas e no Enem!